Accueil > Sommaire > Double aveugle
1
Suivi des patients durant
l’essai
La randomisation construit deux groupes initialement comparables. Encore faut-il que cette comparabilité soit maintenue au cours de l’essai et que rien ne vienne la détruire durant le suivi (« follow-up ») ou lors la mesure du critère de jugement, pour que ces deux groupes ne différèrent tout au long de l’essai que par la nature du traitement expérimental qu’ils reçoivent. L’influence des différents facteurs de confusion doit donc être maintenu identique entre les 2 groupes.
Par exemple, si dans le suivi, les patients d’un groupe reçoivent plus de traitements concomitants que ceux de l'autre groupe, il sera impossible de savoir si la différence obtenue en fin d’essai est bien due au traitement étudié ou si elle provient de la différence entre les traitements concomitants. Un biais est aussi possible si la mesure du critère de jugement ne s’effectue pas de la même façon dans les groupes. On parle de biais de suivi (ou de réalisation) et de biais de mesure.
Exemple
Un nouveau traitement N est comparé au traitement standard S dans la prophylaxie des thromboses veineuses profondes (TVP) en chirurgie. L'étude est réalisée en ouvert. La survenue d'une TVP est détectée à partir de la clinique puis confirmée par phlébographie.
Le nouveau traitement est considéré comme plus efficace que le standard, ce que doit confirmer l'essai.
Subjectivement, les TVP seront plus facilement suspectées avec le traitement standard qu'avec le nouveau traitement, considéré comme plus efficace, Les mêmes signes cliniques seront plus facilement mis sur le compte d'une TVP si l'on considère que le patient reçoit un traitement moyennement efficace que s'il reçoit un traitement considéré comme très efficace. De ce fait, la sensibilité de la recherche des TVP sera plus élevée dans le groupe du traitement standard où la phlébographie sera réalisée plus fréquemment, conduisant à un plus fort taux de détection de TVP.
|
|
Sensibilité |
Incidence
réelle |
Test positif
(incidence observée) |
|
Nouveau traitement |
70% |
10% |
7% |
|
Traitement standard |
90% |
10% |
9% |
Ainsi, bien que la vraie fréquence des
événements soit de 10% dans les deux groupes, l'asymétrie
dans la performance de la recherche du critère de jugement crée
une différence apparente faisant croire à une
supériorité du nouveau traitement. La subjectivité des
investigateurs entraîne un biais
2
Le
double insu
Le double insu évite les biais de suivi et de mesure.
Le double insu (« double blinding ») évite toutes différences dans le suivi et l'évaluation des deux groupes. Le principe du double insu consiste à faire que tous les patients, quelle que soit leur appartenance à l'un des groupes de l'essai, apparaissent identiques. Ceci est obtenu en ne révélant pas la nature exacte du traitement reçu par les patients. Les patients du groupe traité reçoivent un traitement strictement identique en apparence à celui reçu par les patients du groupe contrôle. Les patients du groupe traité sont donc indiscernables des patients du groupe contrôle. Ainsi, tous les agissements pouvant interférer avec l'effet du traitement (traitement concomitant, mesure du critère de jugement, etc.) sont appliqués de façon symétrique aux deux groupes.
Nous avons vu qu'une utilisation asymétrique des traitements concomitants systématiquement plus fréquemment dans un groupe que dans l'autre entraîne un biais (à ce niveau, il convient de ne pas confondre les traitements concomitants donnés à l’entrée de l’étude et les traitement de secours (« rescue treatment ») donné en cas d’échec thérapeutique.). Cependant, il est impossible d'interdire le recours à ces traitements, entre autres par ce qu'il serait non éthique de ne rien faire pour un patient qui s'aggrave. Si les deux groupes sont indiscernables, il sera impossible de recourir plus fréquemment aux traitements concomitants dans un groupe que dans un autre.
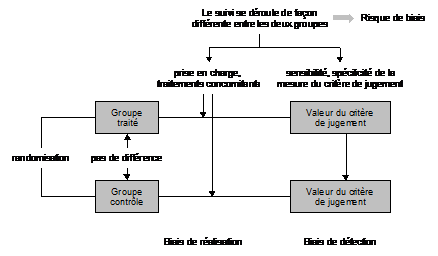
Figure 9
– La randomisation fournit deux groupes comparables, garantissant la
valeur de
Le double insu évite les biais dus à
l’observateur (interprétation subjective des résultats et
hétéro suggestion) et au patient (autosuggestion).
Néanmoins si un traitement est moins efficace qu'un autre, il entraînera un plus grand nombre de patients en échec thérapeutique et donc un taux plus important de recours aux traitements concomitants. Grâce à ces traitements les deux groupes obtiendront finalement le même résultat au niveau du critère de jugement faisant croire à l'absence de différence entre les 2 traitements : le traitement le moins efficace ayant reçu le renfort de traitements concomitants. Dans un essai de supériorité où l’on cherche à montrer que le traitement étudié est supérieur au traitement de référence, ce résultat n’est pas gênant. Aucune différence n’étant notée, l’essai ne pourra pas servir d’argument à l’utilisation du nouveau traitement. Par contre dans un essai dont l’objectif est de montrer l’équivalence des deux traitements, ce mécanisme sera beaucoup plus gênant (ce point sera discuté plus avant dans le chapitre concernant les essais d’équivalence). Pour éviter ce biais, les échecs thérapeutiques ou les absences d'amélioration motivant le recours à un autre traitement doivent être pris en compte comme échec dans le critère de jugement (ce qu'ils sont réellement). Si le critère de jugement n’est pas un événement clinique, mais la valeur d’un paramètre, il devra être mesuré avant l’introduction du traitement concomitant.
Par exemple, dans l’essai d’un antihypertenseur contre placebo, le protocole doit prévoir un traitement de secours pour les patients chez lesquels une aggravation de l’hypertension apparaît. Il s’agit d’un traitement qui sera utilisée à la place du traitement de l’étude sans qu’il soit nécessaire de vérifier la nature du traitement que recevait auparavant le patient.
Le recours au double-aveugle est particulièrement important quand le critère de jugement est de nature subjective. Par exemple, un essai dans la sclérose en plaque a comparé au placebo deux traitements : l’un associant cyclophosphamide et prednisone et l’autre plasmaphérèse et prednisone. Le critère de jugement était l’évaluation par un médecin de l’évolution de la maladie 1. Cette évaluation a été réalisée en double : une fois en aveugle par des médecins ne connaissant pas le traitement du patient (analyse primaire) et une autre fois par les médecins traitants qui connaissaient la nature du traitement reçu par les patients. Avec l’évaluation en aveugle, aucun effet statistiquement significatif n’a pu être mis en évidence, tandis que l’évaluation sans aveugle montre une efficacité du traitement le plus sophistiqué (plasmaphérèse) mais pas de l’autre traitement. Cet exemple illustre comment l’évaluation d’un critère de jugement subjectif non réalisée en aveugle peut favoriser le traitement dans lequel le plus d’espoirs est mis, et ainsi conduire à un biais.
Tableau 1 – Les différents types d’insu
|
Double insu (double aveugle
« double blind ») ·
ni le patient, ni le médecin
investigateur ne connaissent la nature réelle du traitement |
|
Simple insu (simple aveugle) ·
le médecin connaît la nature du
traitement mais pas le patient (les nécessités éthiques
et réglementaires de l’information de patients font que le
simple insu est en pratique impossible )
|
|
Étude en ouvert
(« open design ») ·
le médecin et le patient connaissent la
nature du traitement |
Le terme en ouvert est aussi
parfois utilisé pour désigner une étude non comparative,
sans groupe contrôle.
Le terme « triple
aveugle » est parfois utilisé. Il désigne un essai
dans lequel l’analyse statistique s’effectue sans avoir
connaissance de la nature des traitements. Les traitements sont
identifiés par un code du type « traitement A » et
« traitement B » et ce n’est qu’une fois
l’analyse terminée que la nature exacte des traitements A et B est
révélée. Cette procédure n’a plus cours
actuellement. Pour éviter une certaine subjectivité dans le choix
des analyses statistiques 2, elle est remplacée
par l’établissement, avant la fin de l’essai, d’un
plan d’analyse détaillant la façon dont sera conduite
l’analyse statistique correspondant aux principaux objectifs de
l’essai.
1
Obtention
du double insu
Le but du double insu est de faire que les patients des deux groupes soient indiscernables
Pour obtenir un double-insu il est nécessaire que tous les patients reçoivent apparemment le même traitement. Les patients du groupe contrôle doivent donc recevoir un traitement sans effet mais qui est indiscernable du traitement testé. Il s'agit d'un placebo qui a la même forme galénique que le traitement étudié (appelé parfois verum), qui est donné avec la même fréquence, pour la même durée et qui a le même goût, la même couleur, etc. Ainsi, le traitement administré ne permet pas de distinguer les deux groupes étant donné qu'il a la même apparence quel que soit le groupe auquel appartient le sujet.
Le placebo dans un essai à deux rôles : assurer l'indistinctibilité des deux groupes pour réaliser le double insu, et créer les conditions nécessaires à l'apparition de l'effet placebo chez les patients du groupe contrôle dans le but de prendre en compte ce facteur de confusion.
1.1
Traitements
de natures différentes
Quand le traitement étudié est comparé à un traitement actif de référence il est plus difficile de rendre les deux traitements apparemment identiques. En particulier, si le nouveau traitement étudié s'administre par voie orale et si le traitement contrôle s’administre par voie intra veineuse.
Dans ce cas, le double insu est obtenu par la technique dite du "double placebo". Tous les patients reçoivent un traitement oral et un traitement intraveineux, mais l'un d'entre eux est un placebo. Cependant, les patients du groupe expérimental reçoivent le nouveau traitement par voie orale et le placebo du traitement de référence par voie intraveineuse. Ils bénéficient donc de l'effet du nouveau traitement. Les patients du groupe contrôle bénéficient de l'effet du traitement de référence (administré sous forme intraveineuse alors qu'ils reçoivent sous forme orale le placebo du nouveau traitement).

Figure 10 – Réalisation du double insu à l’aide d’un double placebo dans un essai comparant deux traitements actifs de voies d’administration différentes.
1.2
Nécessité
d’ajustement
Lorsque le traitement évalué nécessite un ajustement de dose (comme par exemple avec un anticoagulant ajusté en fonction du temps de l’INR) la réalisation du double insu s’en trouve compliquée mais n’est pas impossible. Plusieurs solutions sont envisageables. Une tierce personne, différente du médecin ayant en charge le patient, reçoit les résultats des dosages nécessaires à l’ajustement puis communique à l’investigateur la conduite à avoir : augmenter ou diminuer les doses. Le résultat est communiqué à l’investigateur si celui-ci révèle une situation dangereuse pour le patient. Dans les essais contre placebo, des ajustements fictifs sont générés.
Exemple
Dans un essai de statines contre placebo 3, la dose initiale de 20 mg pouvait être doublée si la cholestérolémie restait supérieure à un seuil au bout des premiers mois de traitement. Pour maintenir l’aveugle, les dosages du taux de cholestérol étaient centralisés et seules les instructions relatives au maintien ou au changement de posologie étaient communiquées aux médecins traitants. En cas de cholestérolémie restant très élevée, la valeur des paramètres lipidiques était révélée mais pas la nature du traitement reçu.
2
Acceptabilité
des essais en ouvert
La réalisation d'un double insu est parfois difficilement envisageable, principalement pour des raisons éthiques, par exemple, lors d'une comparaison d'intervention chirurgicale à un traitement médical. La réalisation d'un double insu impliquerait un simulacre d'intervention pour les patients alloués dans le groupe traitement médical ! Des raisons éthiques évidentes rendent irréalisables ce double insu qui a pourtant été pratiqué dans quelques cas.
Lorsque le double aveugle n'est pas possible, il convient que le critère de jugement soit le moins possible sujet à interprétation afin d'éviter l'apparition d'un biais d'évaluation. L'idéal est représenté par les événements cliniques ou le décès. De toute façon un comité d'adjudication travaillant en aveugle du traitement est nécessaire. Dans ces essais en ouvert il convient d'éviter les critères plus ou moins subjectifs (score, échelle, etc.), dont la mesure pourrait être influencée par la connaissance du traitement. Si le recours a de tels critères est néanmoins indispensable, leur évaluation devra être réalisée en aveugle du traitement, par un autre médecin que celui qui assure le traitement et le suivi médical du patient.
Une procédure d'inclusion et de randomisation centralisée est indispensable dans un essai en ouvert. En son absence, il est très facile de favoriser l'attribution d'un des traitements aux patients les plus sévèrement atteints et d'introduire ainsi un biais de sélection. Par exemple, l'utilisation d'enveloppe dans un essai en ouvert est inacceptable.
Exemple
L’étude CAPP 4 est un essai de morbi-mortalité dans l’hypertension qui a comparé le captopril au traitement standard par diurétique ou bêta-bloquants. L’essai a été réalisé en ouvert et a recruté 10 985 patients suivis en moyenne 6,1 ans. La randomisation s’est effectuée à l’aide d’enveloppe. L’analyse des caractéristiques de base révèle un déséquilibre important entre les groupes. La pression artérielle était plus élevée dans le groupe captopril que dans le groupe contrôle (166,6/103,6 vs 163,3/101,2 mm Hg, p<0·0001) ainsi que la proportion de diabétique. Ce déséquilibre introduit un biais de sélection et rend les résultats inexploitables.
3
Levée
d’insu
Dans les essais en double insu, certaines situations d’urgence peuvent nécessiter la levée de l’insu (« code break »), c’est-à-dire de connaître la nature exacte du traitement que reçoit un patient. C’est par exemple le cas en cas de tentatives de suicide avec le traitement de l’étude, ou d’anesthésie générale. Les essais prévoient donc des procédures permettant de le faire 24h sur 24h. Pour éviter des levées intempestives et sans justification, la procédure de levée d’insu doit être centralisée. La mise à disposition de l’investigateur d’une série d’enveloppes scellées à ouvrir en cas de besoin fait courir un risque de levée plus ou moins systématique de l’insu. Même si elles sont justifiées, des levées d’insu en nombre important risquent de biaiser les résultats. Elles peuvent aussi faire courir des rumeurs qui peuvent gêner la poursuite de l’essai.
4
Bibliographie
1. Noseworthy JH, Ebers GC, Vandervoort MK, Farquhar RE, Yetisir E, Roberts R. The impact of blinding on the results of a randomized, placebo-controlled multiple sclerosis clinical trial. Neurology 1994;44(1):16-20.
2. Gotzsche PC. Blinding during data analysis and writing of manuscripts. Controlled Clinical Trials 1996;17(4):285-90; discussion 90-3.
3. Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344:1383-89.
4. Hansson L, Lindholm LH, Niskanen L, for the Captopril Prevention Project (CAPPP) study group. Effect of angiotensin-converting-enzyme inhibition compared with conventional therapy on cardiovascular morbidity and mortality in hypertension: the Captopril Prevention Project (CAPPP) randomised trial. Lancet 1999;353:611-16.
Interprétation des essais cliniques pour la pratique
médicale
www.spc.univ-lyon1.fr/polycop
Faculté de Médecine Lyon - Laennec
Mis à jour : aout 2009